Le syndrome de perméabilité intestinale (leaky gut syndrome) est un phénomène de plus en plus étudié dans la science actuelle. Celle-ci se définit par l’état de la paroi intestinale qui est plus « perméable » qu’à la normale (1, 10). Ainsi, différentes substances, comme des bactéries, des toxines, des nutriments, traversent la paroi intestinale et peuvent entrer dans la circulation sanguine (1, 6). Lorsqu’on parle de la perméabilité intestinale, on s’intéresse plus précisément à la muqueuse, c’est-à-dire à la paroi de l’intestin (1, 10).
On sait maintenant que l’alimentation joue un rôle clé dans la santé de la barrière intestinale, que ce soit pour sa structure (épaisseur de la couche de mucus) ou pour sa fonction (rôles des cellules épithéliales) (3). Explorons ensemble comment la nutrition l’influence et les implications cliniques possibles.
1. Physiologie de la barrière intestinale
Qu’est-ce que la barrière intestinale ?
La muqueuse intestinale est constituée des cellules épithéliales (1, 2, 6). Celles-ci jouent alors un rôle de barrière « physique » (1, 2, 6). Les cellules épithéliales sont reliées entre elles par plusieurs composés, dont les jonctions serrées (1, 2, 3, 5, 6, 10). Ces jonctions sont des composantes essentielles à la barrière intestinale et responsables de ce qui peut circuler adéquatement (certains ions, l’eau, les sucres) et de ce qui ne devrait pas traverser (les bactéries pathogènes, les composés toxiques) (1, 2, 6, 9) ladite barrière.
Dans la paroi intestinale se retrouve aussi du mucus qui varie en composantes tout au long de l’intestin (1, 2, 3). Dans l’intestin grêle, le mucus forme une fine couche discontinue, facilitant l’absorption des nutriments, tandis que, dans le gros intestin, il est composé de deux couches (1, 3). Ces dernières créent une séparation physique, assurent la protection du contenu intestinal et préviennent l’adhérence des bactéries nuisibles (1, 3, 6).
On retrouve également une barrière immunitaire assurant la gestion de l’immunité, composée de cellules protectrices, telles que les défensines, les lymphocytes et les macrophages (1, 2).
La problématique de perméabilité intestinale est présente lorsque la barrière devient « trop perméable » (6). Dans ce contexte, des substances comme des bactéries, des toxines et autres nutriments traversent la paroi et atterrissent dans le système circulatoire (1, 6, 10). Ces éléments déclenchent alors différentes réactions immunitaires (1, 8). Si ce phénomène devient chronique, ces réactions immunitaires et inflammatoires peuvent altérer la fonction des jonctions serrées et créer alors plus de perméabilité intestinale (10).
Quelles sont les implications du microbiote intestinal ?
Les études rapportent que les bactéries intestinales jouent un rôle clé dans l’intégrité de la paroi intestinale (1, 6, 10). En effet, plusieurs fonctions du microbiote sont liées à la régulation de la barrière intestinale, dont le contrôle de la prolifération des bactéries pathogènes, la stimulation du système immunitaire et la synthèse des acides gras à chaîne courte (AGCC) (1, 6, 10). Un déséquilibre du microbiote intestinal, soit une dysbiose, altère les jonctions serrées permettant aux pathogènes et aux toxines, telles que les lipopolysaccharides (LPS), d’entrer (1, 6, 10).
Comment évaluer la perméabilité intestinale ?
Dans les études, la perméabilité est mesurée par différents marqueurs sanguins de l’expression des protéines des membranes de la barrière et des jonctions serrées (1, 2, 3, 4, 10). Parmi les exemples de marqueurs, on note la zonuline, l’occludine et la claudine (1, 3, 4). On peut également mesurer les endotoxines en circulation systématique, comme les LPS, reflétant les dommages potentiels de la paroi (3). Dans les études cliniques, la perméabilité peut aussi être évaluée avec l’absorption intestinale de certains sucres ingérés, comme le lactulose et le mannitol (1). On peut aussi pratiquer une biopsie et constater physiquement le degré de perméabilité, mais ce n’est pas un examen effectué fréquemment, puisque plutôt invasif. L’expérience ainsi que le jugement clinique sont majoritairement utilisés pour évaluer l’état potentiel de la paroi intestinale. La perméabilité est généralement considérée comme le symptôme d’une problématique existante (1, 4, 10).
Quels éléments influencent la santé de la barrière intestinale ?
Plusieurs facteurs peuvent perturber la barrière intestinale. En plus de l’alimentation et des bactéries intestinales, la prise d’antibiotiques, l’âge, les gènes, les infections (H. pylori), la médication, les hormones, les marqueurs inflammatoires, le stress physique et psychologique ainsi que l’intensité de l’activité physique peuvent influencer son intégrité (1, 2, 6).
2. Mécanisme de modulation nutritionnelle
Les aliments consommés influencent l’état de la barrière intestinale. Les AGCC, incluant l’acétate, le butyrate et le propionate (2, 3), font partie des éléments clés favorables à une paroi intestinale saine. En effet, ces molécules sont synthétisées par les bactéries intestinales lors de la fermentation de certains nutriments, dont les fibres et des prébiotiques (1, 2, 5, 6). Le butyrate est un AGCC connu pour son effet positif sur le maintien de l’intégrité de la barrière intestinale en synthétisant des molécules favorables aux jonctions serrées et à la couche de mucus (1, 2, 3, 5, 6, 9). Plusieurs études rapportent que le butyrate et le propionate induisent un « resserrement » sur la perméabilité des jonctions serrées (2, 5). De plus, les AGCC (majoritairement le butyrate) sont des sources énergétiques pour les colonocytes (1, 3). Une déficience en AGCC et en fibres peut compromettre les fonctions épithéliales de la barrière en augmentant la perméabilité intestinale et en provoquant des altérations du mucus (1).
3. Nutriments et composés bioactifs clés
Comme mentionné précédemment, l’alimentation influence la santé de la paroi intestinale. Détaillons ensemble les nutriments clés et leurs impacts.
Les lipides
Les études rapportent qu’une alimentation riche en gras peut augmenter la perméabilité intestinale en modulant l’expression et la distribution des jonctions serrées (3). La réduction des bactéries qui « renforcent » l’intégrité de la barrière intestinale, l’augmentation de celles qui la « réduisent » et les cascades inflammatoires créées sont des mécanismes expliquant les impacts négatifs des gras sur la paroi (3).
Cependant, comme pour plusieurs conditions de santé, l’impact des lipides est variable selon le type de gras. Une alimentation riche en gras saturés a été associée à une augmentation de la perméabilité intestinale par l’impact sur les bactéries (2, 6). À l’inverse, l’acide eicosapentaénoïque (EPA) et l’acide docosahexaénoïque (DHA) ont démontré être efficaces pour supporter l’intégrité de la barrière intestinale (2, 5, 6).
Les fibres et les prébiotiques
Comme évoqué ci-dessus, les fibres et les prébiotiques sont les nutriments fermentés par les bactéries intestinales favorisant la synthèse des AGCC ayant des rôles importants pour la barrière intestinale, dont la régulation de la barrière immunitaire de la muqueuse (1, 3). De même, les fibres peuvent modifier positivement la couche de mucus intestinal (3). On retrouve les fibres alimentaires dans les grains entiers, les légumineuses, les fruits et légumes, les noix et graines. Les sources de prébiotiques sont principalement les betteraves, l’inuline, l’ail et l’oignon, la banane, le poireau et les petits fruits (2, 3, 6).
Pour plus de détails, lire les articles de blogue sur le microbiote intestinal et celui sur les prébiotiques.
Les sucres ajoutés
Une alimentation faible en sucre est favorable pour maintenir les jonctions serrées (1, 2, 7). En effet, plusieurs études se sont penchées sur le rôle de différents sucres (fructose, glucose, sucrose) dans ce contexte (1, 7). Ces sucres ajoutés semblent impliqués dans l’augmentation de la perméabilité intestinale et des cytokines inflammatoires, ainsi que dans la dysfonction des jonctions serrées (1, 2, 7, 9). Certaines études ont observé que l’apport en fructose peut augmenter la perméabilité intestinale et promouvoir la libération des facteurs inflammatoires au foie, augmentant ainsi l’inflammation du foie et systémique (2, 7, 9). Considérons toutefois que ces études sont encore préliminaires. Réduire les sucres ajoutés et les aliments très glucidiques dans leur globalité semble important pour une barrière intestinale saine.
L’alcool
Une consommation élevée d’alcool est associée à un plus grand risque de développer une perméabilité intestinale (1, 3, 5, 6). L’alcool peut inhiber les bactéries bénéfiques, altérer la fonction de la barrière et les AGCC, favoriser une dysbiose ainsi que modifier la composition du microbiote associé à la muqueuse (1, 3, 5). Tout comme pour d’autres conditions de santé, une consommation plus faible, voire nulle, d’alcool est favorable pour la santé intestinale.
Les additifs et émulsifiants
Les additifs alimentaires ont démontré une augmentation de la perméabilité intestinale en interférant avec les jonctions serrées, favorisant le passage d’antigènes immunogènes (1, 6). Pour leur part, les émulsifiants ont été associés à une diminution de la diversité bactérienne ainsi qu’à une augmentation de l’inflammation des muqueuses et une translocation des bactéries (2). Par exemple, le carboxyméthylcellulose (CMC) et le polysorbate 80 (P80) provoquent un amincissement de la couche de mucus (2). En revanche, ces études sont majoritairement pratiquées chez les animaux et peu sont réalisées chez l’humain pour constater les mêmes impacts. D’autres recherches sont nécessaires.
Voici un schéma sur les nutriments qui influencent la barrière intestinale
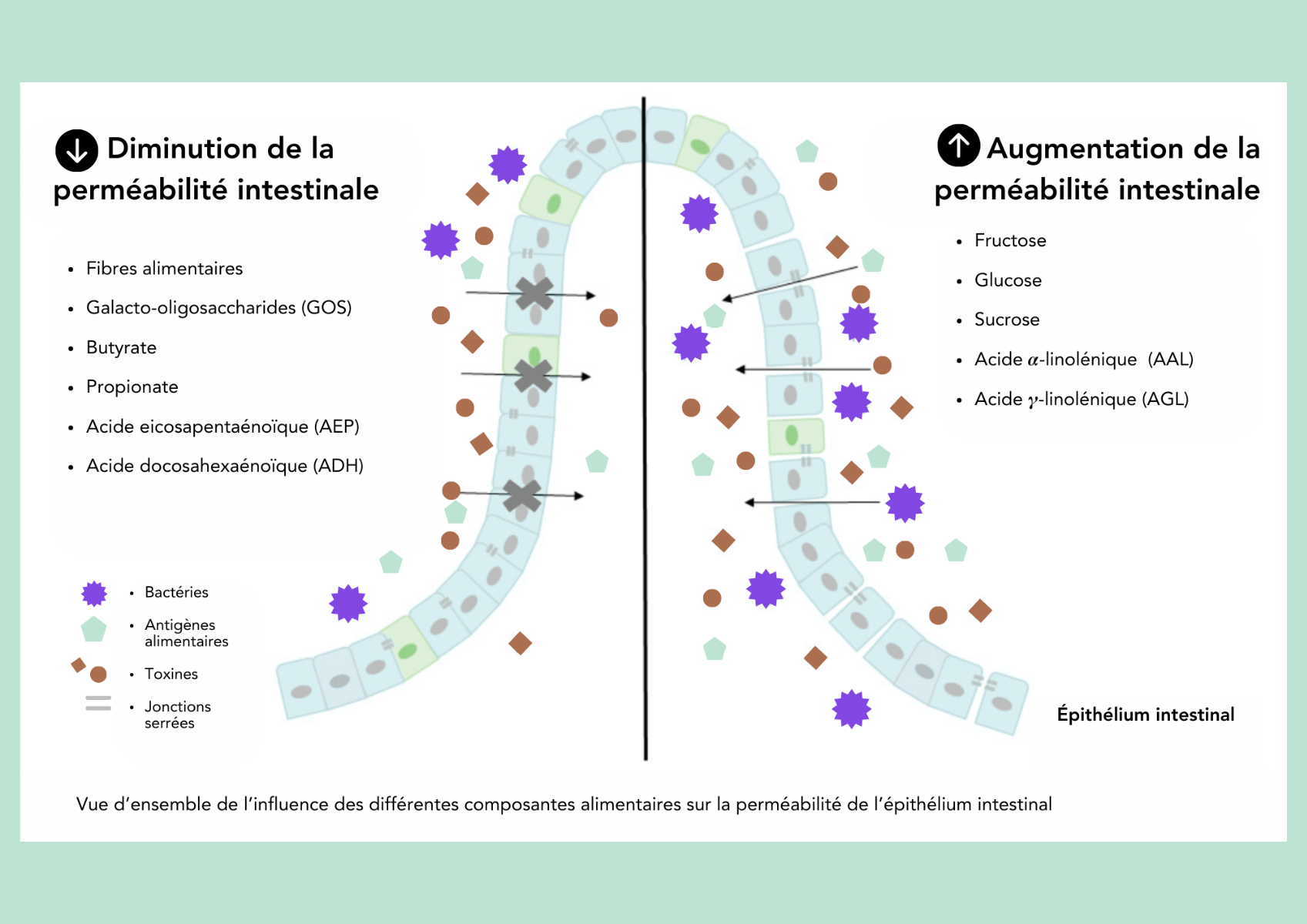

Traduit de Binienda et al. (2020) (2)
4. Implications cliniques
En plus de bien comprendre l’impact de la nutrition sur la perméabilité intestinale, les études se sont intéressées aux applications dans plusieurs conditions de santé. À ce sujet, on rapporte différentes conséquences systémiques associées au dysfonctionnement de la barrière intestinale, comme une inflammation accrue, une activation de la réponse immunitaire, un stress oxydatif et une diminution de la sensibilité à l’insuline affectant les tissus et les organes comme le foie, les tissus adipeux, les muscles et le cerveau (3).
Voici une liste des différentes pathologies présentant une hyperperméabilité intestinale et certains mécanismes potentiels impliqués (1, 2, 3, 4, 6, 7, 8, 9, 10) :
- Syndrome de l’intestin irritable (SII) : observations de niveaux plus faibles de zonuline et occludine dans les tissus intestinaux, présence d’une dysbiose, translocation bactérienne
- SIBO (Small intestinal bacterial overgrowth) : altération du microbiote intestinal
- Maladie cœliaque : lors de l’ingestion de gluten, augmentation de l’inflammation intestinale, altération des jonctions serrées
- Obésité : changement dans la composition des bactéries intestinales, augmentation des endotoxines plasmatiques, réduction des AGCC
- Maladies inflammatoires de l’intestin (MII) comme la maladie de Crohn et la colite ulcéreuse : niveau supérieur d’inflammation, altération des jonctions serrées
- Arthrite rhumatoïde : réaction inflammatoire, altérations du microbiote intestinal
- Maladies cardiovasculaires : augmentation des endotoxines et des marqueurs inflammatoires, altération du microbiote intestinal
- Diabète de type 1 et de type 2 : altération de la fonction de la barrière intestinale, translocation bactérienne
- Stéatose hépatique non alcoolique, maintenant nommée maladie hépatique stéatosique associée à un dysfonctionnement métabolique (MASLD) : dysfonctionnement de l’axe intestin-foie, présence de dysbiose, altération des bactéries, réactions inflammatoires
Actuellement, la science rapporte des associations entre la perturbation de la barrière intestinale et ces pathologies (1, 5). Il n’y a pas de lien de causalité encore avéré et d’autres études sont nécessaires pour établir « l’ordre » de perturbation (1, 5). Est-ce que ce sont les maladies qui causent la perméabilité intestinale ou l’inverse? Cela n’a pas encore été démontré.
Finalement, malgré les recommandations générales visant à maintenir une paroi intestinale saine, le tout reste à individualiser. En plus des maladies présentes, les habitudes de vie, les symptômes digestifs et la signature bactérienne restent uniques à chacun. Une évaluation et une prise en charge nutritionnelle personnalisée sont primordiales pour assurer un maintien des changements alimentaires et une optimisation de la santé digestive!
Conclusion
Pour conclure, plusieurs éléments peuvent influencer la santé de la muqueuse intestinale. Les données scientifiques sont de plus en plus disponibles sur le sujet et porteuses d’espoir. Évidemment, l’adoption de saines habitudes de vie de manière générale aura un effet favorable sur cette dernière. Miser sur les fibres alimentaires et les oméga-3 ainsi que réduire la consommation de gras saturés, de sucres ajoutés, d’alcool et d’aliments transformés est contributif à une paroi intestinale saine.
Cet article transmet uniquement des informations générales qui ne remplacent pas les recommandations ni les soins d’un professionnel de la santé. L’effet des produits présentés dans ce texte peut varier d’une personne à l’autre; certains d’entre eux peuvent être contre-indiqués pour vous et susceptibles d’interagir avec vos médicaments si vous en prenez. Dans le cas où vous êtes suivi pour un problème de santé, consultez un professionnel de la santé avant de les intégrer à votre alimentation.
Références :
[1] Aleman et al. (2023) Leaky Gut and the Ingredients That Help Treat It: A Review. Molecules. Jan 7;28(2):619. https://pubmed.ncbi.nlm.nih.gov/36677677/
[2] Binienda et al. (2020) Dietary Carbohydrates and Lipids in the Pathogenesis of Leaky Gut Syndrome: An Overview. Int J Mol Sci Nov 8;21(21):8368. https://pubmed.ncbi.nlm.nih.gov/33171587/
[3] Camilleri et Vella (2022) What to do about the leaky gut. Gut Feb;71(2):424-435. https://pubmed.ncbi.nlm.nih.gov/34509978/
[4] Chae et al. (2024) Diet-Induced Gut Dysbiosis and Leaky Gut Syndrome. J Microbiol Biotechnol Apr 28;34(4):747-756. https://pubmed.ncbi.nlm.nih.gov/38321650/
[5] De Santis et al. (2015) Nutritional Keys for Intestinal Barrier Modulation. Front Immunol Dec 7;6:612. https://pubmed.ncbi.nlm.nih.gov/26697008/
[6] Di Vincenzo et al. (2024) Gut microbiota, intestinal permeability, and systemic inflammation: a narrative review. Intern Emerg Med Mar;19(2):275-293. https://pubmed.ncbi.nlm.nih.gov/37505311/
[7] Ma et al. (2022) Excessive intake of sugar: An accomplice of inflammation. Front Immunol Aug 31;13:988481. https://pubmed.ncbi.nlm.nih.gov/36119103/
[8] Pickard et al. (2017) Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev Sep;279(1):70-89. https://pubmed.ncbi.nlm.nih.gov/28856738/
[9] Twardowska et al. (2022) Preventing Bacterial Translocation in Patients with Leaky Gut Syndrome: Nutrition and Pharmacological Treatment Options. Int J Mol Sci Mar 16;23(6):3204. https://pubmed.ncbi.nlm.nih.gov/35328624/
[10] Wells et al. (2017) Homeostasis of the gut barrier and potential biomarkers. Am J Physiol Gastrointest Liver Physiol Mar 1;312(3):G171-G193. https://pubmed.ncbi.nlm.nih.gov/27908847/